临床研究
Clinical Research Supernova Scientist
新星专栏
导
语
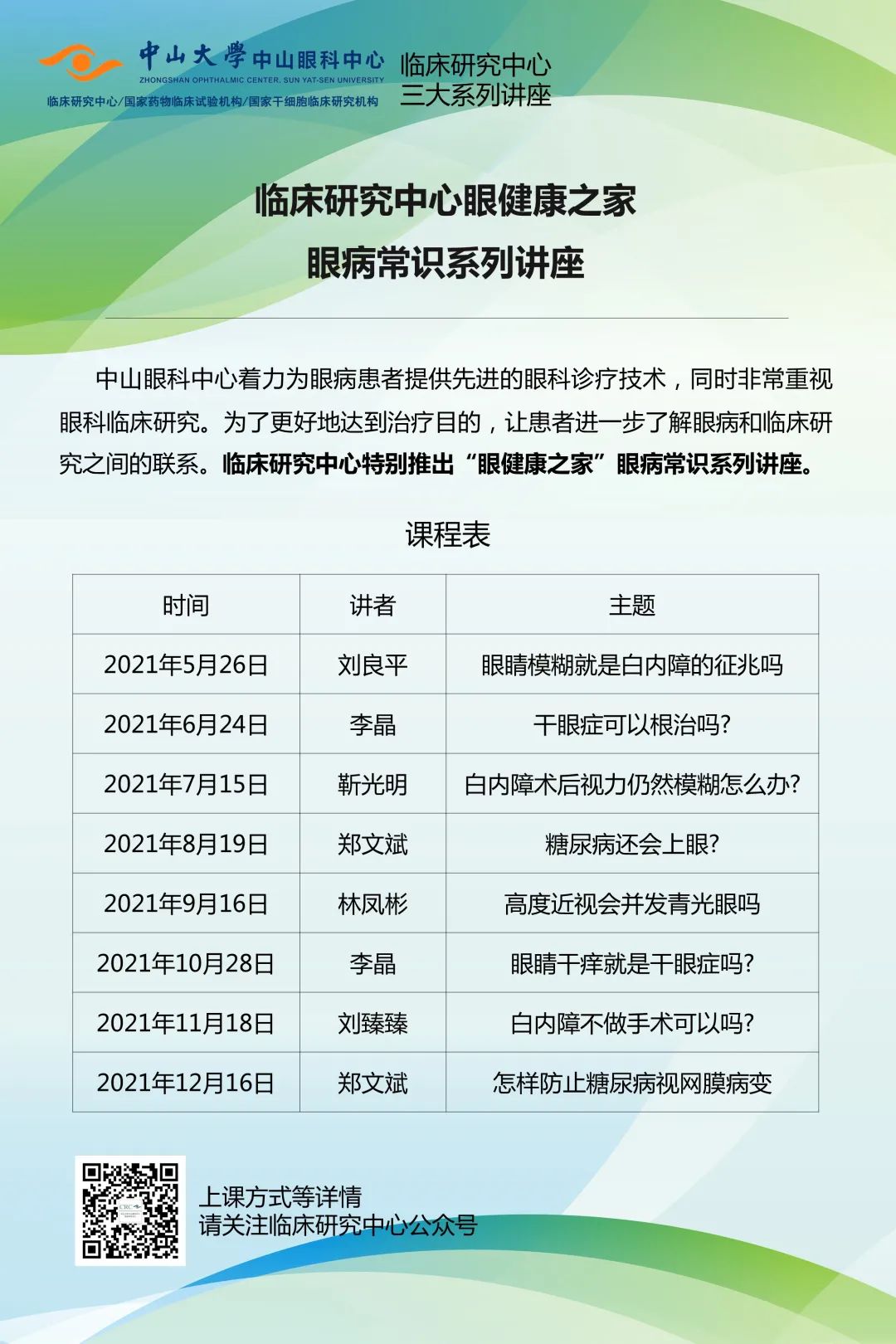
临床研究是医学发展的核心驱动力,需要不断创新研究方法,打破传统思维模式,来迎接新的机遇与挑战。从本月本期开始,我们将开设“临床研究新星”专栏,陆续报道10位中山眼科中心优秀临床研究青年才俊。旨在展示眼科临床研究领域优秀青年科学家的风采,鼓励更多年轻医生加入眼科临床研究行列。
李飞医生是中山眼科中心临床研究中心的一名青年研究医生,导师张秀兰教授对他的评价是:“天生的科研苗子”。他的身上充满科学家严谨、专注的气质,也洋溢着年轻人朝气和魅力。

李飞医生
李医生是中山大学中山眼科中心八年制博士。在导师张秀兰教授的栽培下,致力于青光眼领域相关研究。近三年已在Ophthalmology、NPJ Digital Medicine、Medical Imaging Analysis、IEEE Transactions On Medical Imaging、BJO、IOVS、Acta Ophthalmologica等医学及眼科主流杂志发表论文30余篇(21篇JCR Q1,9篇中科院医学1区),其中以第一或共一作者发表论文16篇,累计影响因子达185.5,单篇最高被引130次;申请发明专利14项(授权4项)、软著2项,参与制定我国首个关于眼底彩照数据质量控制规范的团体标准《眼底彩照标注与质量控制规范(T/CAQI 166-2020)》。主持1项国家自然科学基金、1项省自然面上项目,并参与1项科技部重点研发课题及多项国家自然科学基金、广州市科技计划项目。尽管是青年学者,李飞医生具备广阔的国际视野,已多次在国内外权威学术会议做特邀发言并获奖。和众多国外研究者的接触与合作经历,让他深刻地认识到国内研究环境、研究人员的优势与差距,明确了未来努力和改进的方向。
目前他在人工智能方向取得许多成绩。在张秀兰教授的指导下,借助中山眼科中心临床研究中心这一丰富的资源平台,李飞医生及其团队与多个国家的科研人员合作,连续在眼科学及医学影像领域顶级期刊发表原创性论著,先后研发出基于视野诊断APP、视野及眼后节OCT影像多模态诊断算法、电子房角镜系统,精准诊断青光眼性视神经损伤、评估房角形态;在2018年连续获得MICCAI OMIA大会的最佳论文奖(Best Paper Award)、亚太青光眼大会Best Oral Abstract、亚太眼科大会及亚太青光眼大会Travel Grant。
李飞医生生活照
人工智能的发展,离不开高质量的标准数据库,借此契机,李飞医生创立了国际首个也是目前最大的多病种眼科影像数据集iChallenge(https://eye.baidu.com)。该数据库2018年由中山眼科中心发起,目前包括REFUGE、REFUGE2、ADAM、AGE、PALM、GAMMA六个子集,覆盖青光眼、黄斑变性、病理性近视多个疾病,提供迄今世界上最精细的眼科影像标注数据,囊括疾病诊断标签、病灶语义标签,为探索提升AI算法可解释性、通用性提供了丰富的数据资源。iChallenge已连续4年在MICCAI会议上举办相关挑战赛,吸引了国内科技公司(腾讯、平安医疗等)踊跃参赛,更得到国际的一致认可,已成为MICCAI会议上青光眼AI算法的标准数据库,被超过220篇论文引用。
李飞医生的脑海里面总是充满各种超前的想法。基于他对于青光眼的深刻认识和理解,他主导了多项围绕青光眼各类研究方向的课题。他具备扎实的临床背景,对青光眼的各方面有及其深刻的认识和独到的见解;同时有丰富的基础科研经历,融会贯通不同学科知识,分析各类研究都能从正确角度切入;从不放弃学习新知识,随时准备开拓更广阔的研究领域。
结语
李飞医生坦言:是导师的眼界、气魄和胸怀感动了他,是临床研究中心平台帮助了他,是中山眼科中心的学术氛围培育了他!未来他将继续在眼科学领域奋进,医学AI研究只是开端,期待他在更多领域取得突破性成果,让我们共同来见证吧!
附:代表性论文(#为第一作者):
1. Li F#, Yang Y#, Sun X#, Qiu Z, Zhang S, Tun TA, Mani B, Nongpiur ME, Chansangpetch S, Ratanawongphaibul K, Manassakorn A, Tantisevi V, Rojanapongpun P, Lin F, Cheng W, Zhou R, Liu Y, Chen Y, Xiong J, Tan M*, Aung T*, Xu Y*, Ting DS, Zhang X*. Digital Gonioscopy based on Three-dimensional Anterior Segment Optical Coherence Tomography: an international multicenter study. Ophthalmology. 2021 Oct 4.
2. Xiong J#, Li F#, Song D#, Tang G, He J, Gao K, Zhang H, Cheng W, Song Y, Lin F,Hu K, Wang P, Olivia Li JP, Aung T*, Qiao Y*, Zhang X*, Ting DS. Multi-modal Machine Learning using Visual Fields and Peripapillary Circular OCT Scans in Detection of Glaucomatous Optic Neuropathy. Ophthalmology. 2021 Jul 30.
3. Song D#, Fu B#, Li F#, Xiong J, He J, Zhang X*, Qiao Y. Deep Relation Transformer for Diagnosing Glaucoma With Optical Coherence Tomography and Visual Field Function. IEEE Trans Med Imaging. 2021 Sep;40(9):2392-2402.
4. Fu H#, Li F#, Xu Sun, Cao X, Liao J, José Ignacio Orlando, Tao X, Li Y, Zhang S, Tan M, Yuan C, Bian C, Xie R, Li J, Li X, Wang J, Geng L, Li P, Hao H, Liu J, Kong Y, Ren Y, Hrvoje Bogunović, Zhang X*, Xu Y* , for iChallenge-PACG study group. AGE challenge: Angle Closure Glaucoma Evaluation in Anterior Segment Optical Coherence Tomography. Med Image Anal 2020 Dec;66:101798.
5. Li F#, Song D#, Chen H#, Xiong J, Li X, Zhong H, Tang G*, Fan S, Dennis S C Lam, Pan W, Zheng Y, Li Y, Qu G, He J, Wang Z, Jin L, Zhou R, Song Y, Sun Y, Cheng W, Yang C, Fan Y, Li Y, Zhang H, Yuan Y, Xu Y, Xiong Y, Jin L, Lv A, Niu L, Liu Y, Li S, Zhang J, Linda M Zangwill, Alejandro F Frangi, Tin Aung, Ching-Yu Cheng, Qiao Y*, Zhang X* , Daniel S W Ting. Development and clinical deployment of a smartphone-based visual field deep learning system for glaucoma detection. NPJ Digit Med. 2020 Sep 22;3:123.
下期预告
临床研究新星之陈士达医生

临床研究中心简介
中山眼科临床研究中心是国家药物临床研究试验机构、国家医疗器械临床研究机构、国家干细胞临床研究机构所在地,为全院提供服务、管理、协调、培训的临床研究一站式平台。自2013年成立以来,已承接71个注册类临床试验,404个研究者发起非注册类临床研究项目(IIT),发表775篇临床研究论文,包括在自然(Nature)、美国医学会杂志(JAMA)、柳叶刀(LANCET)、PLOS Medicine、国际医学影像杂志(MIA)等国际顶级医学杂志发表多篇原创性临床研究论文及成果。已成为符合国际标准、具有专业临床研究团队、规范、高效的临床研究中心。在临床研究中心平台的支持下,高水平临床研究论文发表数量节节攀升,临床研究硕果累累,刘奕志、何明光、林浩添、张秀兰、张清炯、曾阳发、郑颖丰等教授的临床研究团队不断在临床研究中心平台产出重要论著成果。


---来源:临床研究中心---
---编辑:郭燕婷---
---审核:陈翔---
---审定:张秀兰---